A enzima G6PD cataliza a oxidação da glicose-6-fostato a 6-fosfogluconato, enquanto reduz concomitantemente a forma oxidada de NADP (nicotinamida adenina dinucleotideo fosfato) a NADPH, um cofator em diversas reações biosintéticas e que mantém a glutationa na sua forma reduzida. A glutationa reduzida retira os metabolitos oxidativos perigosos das células e, com ajuda da enzima glutationa peroxidase, converte peróxido de hidrogênio em água.
Os glóbulos vermelhos dependem da atividade da G6PD porque é a única fonte de NADPH que protege as células contra o estresse oxidativo; portanto, indivíduos com deficiência de G6PD não podem usar drogas oxidativas porque os glóbulos vermelhos hemolisam rapidamente sob estresse. É uma das causas de anemia hemolítica crônica.
Vamos entender a Glutationa:
A glutationa é um tripeptídeo com importante função antioxidante, prevenindo dano a importantes componentes celulares causados por EROs (espécies reativas de oxigênio). O grupo tiol presente na molécula de glutationa é um grupo redutor, servindo de doador de prótons e, assim, sendo responsável pela atividade biológica da glutationa. A provisão desse aminoácido é o fator limitante para a síntese de gluationa pelas células, já que a cisteína é relativamente rara em alimentação e, ainda, se for liberada como aminoácido livre, é tóxica e catabolizada espontaneamente no trato gastrointestinal e no plasma sanguíneo.
Além disso, a glutationa é o principal agente antioxidante endógeno — que é produzido pelo organismo, de modo que não precisamos ingeri-lo —, e pode participar tanto da neutralização direta de radicais livres e EROs quanto na manutenção de antioxidantes exógenos em suas formas reduzidas (ou seja, ativas), como as vitaminas C e E.
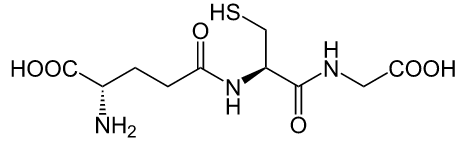
Estrutura da glutationa.
Pode-se encontrar glutationa em sua forma reduzida (GSH) ou oxidada, glutationa dissulfeto (GSSG). A importância deste par é tal que a razão GSH/GSSG é normalmente utilizada para estimar o estado de oxidorredução (referente à toxicidade) dos sistemas biológicos. Em situações normais, a GSSG representa apenas uma pequena fração da glutationa total. Ao se tornar reativa, a glutationa rapidamente se liga a outra glutationa reativa e forma a glutationa oxidada.
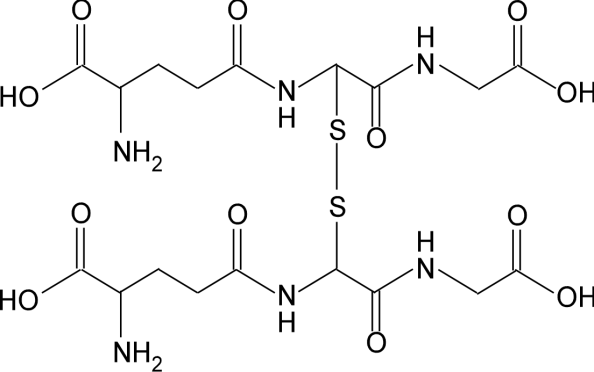
Estrutura oxidada da glutationa.
No entanto, após ser oxidada, a glutationa pode ser reduzida novamente por ação da enzima glutationa redutase (GSR). NADPH reduz a FAD presente na GSR para produzir um ânion FADH, que rapidamente quebra a ligação dissulfeto entre as duas moléculas de glutationa. Desta forma, para cada grupo GSSG e NADPH, obtem-se duas moléculas de glutationa reduzida, que recuperam suas funções de antioxidante.
A glutationa, também, é importante na regulação do ciclo do ácido nítrico, que é fundamental para a vida, apesar de poder ser prejudicial se mal regulado. Ela também é utilizada na síntese e reparo de DNA, síntese proteica, transporte de aminoácidos, ativação de enzimas. Pode-se dizer que cada sistema corporal pode ser afetado pelo estado da glutationa, especialmente os sistemas imune, nervoso, gastrointestinal e os pulmões.
Referências:
Allen J, Bradley RD (September 2011). “Effects of oral glutathione supplementation on systemic oxidative stress biomarkers in human volunteers”. Journal of Alternative and Complementary Medicine.